ცოდნა სინათლეა - Knowledge is light - Знание свет -
1929 წელს გერმანელმა ქიმიკოსმა ფრიდრიხ პანეთმა ამოიცნო მეთილის და ეთილის რადიკალები. ერთ-ერთ ექსპერიმენტში მან დაშალა ტეტრამეთილის ტყვია წყალბადის ნაკადში სითბოს მდგრადი მინის მილში. ამ შემთხვევაში, წარმოიქმნა მეთილის რადიკალები, რომლებიც წყალბადის დინებას მიჰყავდა შემდგომ მილის გასწვრივ, და მეტალის ტყვია, რომელიც სარკის სახით იშლება შიდა დიამეტრზე. ტეტრამეთილის ტყვიის დაშლის ადგილიდან 30 სმ-ში მილის შიგნით მდებარეობდა კიდევ ერთი წინასწარ დატანილი ტყვიის სარკე. გამვლელი მეთილის რადიკალები რეაგირებდნენ ამ ტყვიასთან, კვლავ წარმოქმნიდნენ ტეტრამეთილის ტყვიას, რომელიც კონდენსირებული იყო მცენარის ბოლოს. იმავე ექსპერიმენტმა შესაძლებელი გახადა დაშლის ადგილსა და ტყვიის სარკეს შორის მანძილის ცვალებადობით, აგრეთვე წყალბადის ნაკადის სიჩქარით, შეფასდეს რადიკალების სიცოცხლის ხანგრძლივობა. ექსპერიმენტულ პირობებში (1-2 მმ Hg-ზე) ეს იყო დაახლოებით 0,0084 წამი.
- 1930 წელს გ.ა.რაზუვაევმა და ვ.ნ.იპატიევმა შეისწავლეს დიმეთილმერკურიის ფოტოლიზი ნახშირბადის ტეტრაქლორიდში და დაადგინეს, რომ პროცესის დროს წარმოიქმნება ისეთი პროდუქტები, რომლებიც შეიძლება წარმოიქმნას მხოლოდ ვერცხლისწყალ-ნახშირბადის ბმის ჰომოლიტური დაშლის დროს. ეს იყო მტკიცებულება იმისა, რომ თავისუფალი რადიკალები შეიძლება არსებობდნენ ხსნარებში.
- რადიკალების სტაბილურობა განიხილება თერმოდინამიკური და კინეტიკური პოზიციებიდან, თუმცა უმეტეს შემთხვევაში ორივე ტიპის ფაქტორი ერთდროულად მოქმედებს. რადიკალების თერმოდინამიკური სტაბილურობა დაკავშირებულია იმასთან, თუ რამდენად ეფექტურად ხდება დაუწყვილებელი ელექტრონის დელოკალიზაცია, ვინაიდან დელოკალიზაცია ამცირებს თავისუფალი რადიკალის ფორმირების ენთალპიას. რადიკალის წარმოქმნის ენთალპია შეიძლება შეფასდეს ბმის დისოციაციის ენერგიიდან, რომლის რღვევა იწვევს ამ რადიკალის წარმოქმნას .
- შედეგად, ალიფატური რადიკალების სერიაში თერმოდინამიკური სტაბილურობა იცვლება შემდეგნაირად:
კინეტიკური სტაბილურობა დაკავშირებულია რადიკალის რეაქტიულობასთან სხვა მოლეკულებთან და რადიკალებთან. კინეტიკურ სტაბილურობაზე, პირველ რიგში, გავლენას ახდენს ნაყარი შემცვლელების არსებობა რეაქციის ცენტრთან ახლოს. თუ სტერილური დაბრკოლებები რეაგენტის რადიკალთან მიახლოებისას საკმარისად დიდია, მაშინ ასეთი რადიკალი თავისუფალი სახით შეიძლება არსებობდეს საკმაოდ დიდი ხნის განმავლობაში. კინეტიკურად სტაბილურ რადიკალებს ასევე უწოდებენ ხანგრძლივ .
ხანმოკლე თავისუფალი რადიკალები
ხანმოკლე თავისუფალ რადიკალებს მიეკუთვნება ისეთები, რომლებშიც ლოკალიზებულია დაუწყვილებელი ელექტრონი, ანუ რომლებსაც არ გააჩნიათ სტაბილიზაციის მექანიზმები მეზობელი ორბიტალების მონაწილეობით ან მოცულობითი შემცვლელებით დაფარვის გამო. ხანმოკლე რადიკალებია, მაგალითად, NH2·, CH3·, OH·, SiH3· და ა.შ. ასეთი რადიკალები უნდა იყოს სტაბილიზირებული ან ძლიერი გაგრილებით (თხევადი ჰელიუმი, წყალბადი, აზოტი ან არგონი), ან გალიის ეფექტის გამო, როდესაც თავისუფალი რადიკალები დაბალ ტემპერატურაზეა, ისინი გარშემორტყმულია მინისებური გამხსნელის მოლეკულებით .
- მოკლევადიანი თავისუფალი რადიკალები წარმოიქმნება ნივთიერებაზე ზემოქმედებით სხვადასხვა ფიზიკური ან ქიმიური საშუალებებით. ტიპიური მაგალითია მეთილის რადიკალის წარმოქმნა ნატრიუმის აცეტატის ელექტროლიზის დროს კოლბის რეაქციის დროს.
- ხანმოკლე რადიკალები ასევე წარმოიქმნება ფოტოლიზით. ამ შემთხვევაში ნივთიერების მიერ შთანთქმული კვანტის ენერგია უნდა აღემატებოდეს მისი ერთ-ერთი ქიმიური ბმის დისოციაციის ენერგიას.
- ზოგიერთი ორგანული ნაერთი, შესაბამისი ბმის დაბალი დისოციაციის ენერგიით, პიროლიზის დროს იძლევა თავისუფალ რადიკალებს. ამრიგად, ორგანული პეროქსიდების გათბობა (ბენზოილის პეროქსიდი, ტერტ-ბუტილ ჰიდროპეროქსიდი, კუმილ პეროქსიდი, ტერტ-ბუტილ პეროქსიდი) იწვევს O-O ბმის ჰომოლიზურ გაყოფას და ორი რადიკალის წარმოქმნას.
| რადიკალები | დისოციაციის საფეხური | რადიკალები | დისოციაციის საფეხური |
|---|---|---|---|
| Ph3C• | 2 | трет-Bu(п-PhC6H4)2C• | 74 |
| (п-PhC6H4)Ph2C• | 15 | (Ph2C=CH)Ph2C• | 80 |
| (β-C10H7)3C• | 24 | (п-PhC6H4)3C• | 100 |
| (α-C10H7)Ph2C• | 60 | (Ph3C)Ph2C• | 100 |
ინდოფენოქსილის რადიკალი
არსებობს მთელი რიგი გრძელვადიანი რადიკალები, რომელთა რადიკალური ცენტრი მდებარეობს აზოტის ატომზე. ამრიგად, ამინილის რადიკალები, სტაბილური 25 °C ტემპერატურაზე, მიიღება მეორადი ამინების დაჟანგვით. განსაკუთრებით სტაბილურია ვერდაზილის რადიკალები, რომლებიც ყველაზე სტაბილურ ორგანულ პარამაგნიტებს შორის არიან. მათი ნახევარგამოყოფის პერიოდი ჰაერში ოთახის ტემპერატურაზე შეიძლება იყოს მრავალი წელი.
- იმის გამო, რომ თავისუფალ რადიკალებს აქვთ დაუწყვილებელი ელექტრონი, ისინი ავლენენ დამახასიათებელ ქიმიურ თვისებებს. ამრიგად, ისინი რეაგირებენ სხვა ნაწილაკებთან, რომლებიც შეიცავს დაუწყვილებელ ელექტრონს: თავისუფალ რადიკალებს (მათ შორის რეკომბინაციას საკუთარ თავთან), ლითონებთან და მოლეკულურ ჟანგბადთან.
- თავისუფალ რადიკალებს ასევე შეუძლიათ რეაგირება ნაერთებთან, რომლებიც ადვილად იშლება ატომებად.
- ერთ რადიკალს შეუძლია წყალბადის ატომის აბსტრაქცია მეორე რადიკალისგან: ამ შემთხვევაში ხდება დისპროპორციულობა (წარმოიქმნება ერთი გაჯერებული და ერთი უჯერი ნაერთი) და სისტემაში რადიკალების საერთო რაოდენობა მცირდება.
- ასევე არსებობს რეაქციები რადიკალური ცენტრის გადაცემით, რომლის დროსაც დაუწყვილებელი ელექტრონი, წყალბადის აბსტრაქციის ან ორმაგ ბმაში რადიკალის დამატების შედეგად, მთავრდება სხვა ნაწილაკზე.
- ასევე არის რეაქციები, რომლებიც დამატების საპირისპიროა, როდესაც რადიკალები იშლება β-პოზიციაში ბმის გაწყვეტით. ასეთი ფრაგმენტაცია განსაკუთრებით დამახასიათებელია ალკოქსი რადიკალებისთვის, რომლებიც, რამდენიმე დაშლის ბილიკის არსებობისას, უპირატესობას ანიჭებენ ისეთს, რომელიც წარმოქმნის უფრო სტაბილურ ალკილის რადიკალს.
თავისუფალ რადიკალებს ახასიათებთ გადაწყობის რეაქციები, მაგრამ რადიკალების შემთხვევაში წყალბადის ატომები და ალკილის ჯგუფები იშვიათად მიგრირებენ (განსხვავებით კარბოკაციონების გადაწყობისგან). გაცილებით ხშირია ფენილის ჯგუფის ან ჰალოგენის ატომების მიგრაცია
.გამოვლენა და ანალიზი
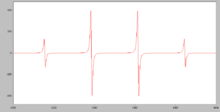
თავისუფალი რადიკალები გამოვლენილია მათი პარამაგნიტური თვისებების გამო. ამ მიზნით ძირითადად გამოიყენება ელექტრონული პარამაგნიტური რეზონანსის მეთოდი (EPR). EPR სპექტრები შესაძლებელს ხდის არა მხოლოდ თავისუფალი რადიკალების აღმოჩენას, არამედ ინფორმაციის მოპოვებას მათი სტრუქტურისა და დაუწყვილებელი ელექტრონის დელოკალიზაციის ხარისხის შესახებ. ამისათვის გამოიყენება ორი პარამეტრი: g-ფაქტორი და ჰიპერწვრილი გაყოფის მუდმივი. პირველი მათგანი არის ქიმიური ცვლის ანალოგი NMR სპექტროსკოპიაში.
ჰიპერწვრილი გაყოფა ხდება დაუწყვილებელი ელექტრონის რადიკალის მაგნიტურ ბირთვებთან ურთიერთქმედების გამო. თუ ელექტრონი ურთიერთქმედებს ბირთვთან, რომელსაც აქვს სპინის ნომერი I, მაშინ გაყოფის შედეგად ჩნდება 2I+1 წრფე. თუ არსებობს რამდენიმე ასეთი ბირთვი, მაგალითად, n, მაშინ წრფეების რაოდენობა ხდება 2nI+1-ის ტოლი. პროტონს აქვს სპინის რიცხვი +½, ამიტომ n ეკვივალენტური პროტონი ყოფს EPR სპექტრის ხაზს n+1 ხაზებად. ამ ხაზების ფარდობითი ინტენსივობა შეესაბამება ბინომიურ კოეფიციენტებს.
ტრიფენილმეთილის რადიკალის სპექტრი კიდევ უფრო რთულია, რადგან იქ დაუწყვილებელი ელექტრონი ურთიერთქმედებს 6 ეკვივალენტურ პროტონთან ორთო პოზიციაში, 6 ეკვივალენტურ პროტონთან მეტა პოზიციაში და 3 ეკვივალენტურ პროტონთან პარა პოზიციაში. ამ შემთხვევაში, ეკვივალენტური პროტონების თითოეული ჯგუფიდან ხაზების რაოდენობა უნდა გამრავლდეს, ამიტომ ხაზების ჯამური რაოდენობა ამ კატიონის EPR სპექტრში არის 7·7·4 = 196. რთული რადიკალების სპექტრების გაშიფვრა ხდება თეორიული გაანგარიშებით. სპექტრები და მათი შედარება ექსპერიმენტულებთან .

თავისუფალი რადიკალების კონცენტრაცია ნიმუშში განისაზღვრება სტანდარტის სპექტრის და ტესტის ნიმუშის სპექტრის ერთდროულად ჩაწერით. შემდეგ სიგნალის ინტენსივობა შედარებულია. სტანდარტად ხშირად გამოიყენება დიფენილპიკრილჰიდრაზილის რადიკალი Ph2N-N•-C6H2(NO2)3. იგივე რადიკალი, რომელსაც აქვს მუქი მეწამული ფერი, შესაძლებელს ხდის დინამიკაში რადიკალების წარმოქმნისა და მოხმარების მონიტორინგს, ვინაიდან სხვა რადიკალებთან ურთიერთქმედებისას ფერი იცვლება ყვითლად ან ქრება .
კომპლექსური თავისუფალი რადიკალები შესწავლილია ელექტრონულ-ბირთვული ორმაგი რეზონანსის (ENDOR) და ქიმიური ბირთვული პოლარიზაციის მეთოდების გამოყენებით. თუ თავისუფალი რადიკალის კონცენტრაცია ხსნარში საკმარისია, მისი შესწავლა შესაძლებელია NMR-ით
გამოყენება
გრძელვადიანი თავისუფალი რადიკალები გამოიყენება როგორც სტაბილიზატორები, რომლებიც ხელს უშლიან ჟანგვის და პოლიმერიზაციის პროცესებს: კერძოდ, ისინი ასტაბილურებენ აკრილონიტრილს, ვინილის აცეტატს, ვინილიდენ ქლორიდს, სტირონს, ფურფურალს, ცხიმებსა და ზეთებს. მოლეკულურ ბიოლოგიაში ისინი გამოიყენება როგორც სპინ ლეიბლი. ისინი ასევე გამოიყენება ფოტოგრაფიული მასალების, პოლიმერული საფარების, ხელსაწყოების დამზადებაში, გეოფიზიკასა და ხარვეზების გამოვლენაში.
ხანმოკლე რადიკალები ბუნებაში გვხვდება, როგორც შუალედური სახეობები სხვადასხვა ქიმიურ რეაქციებში, როგორიცაა რადიკალური ჰალოგენაცია.
თავისუფალი რადიკალები ასევე წარმოიქმნება ადამიანის ორგანიზმში ნორმალური ცხოვრებისეული საქმიანობის დროს: პროსტაგლანდინების ბიოსინთეზის დროს, მიტოქონდრიისა და ფაგოციტების მუშაობაში. დაბერების პროცესი დაკავშირებულია ორგანიზმში რადიკალების წარმოქმნასთან.








![{\displaystyle {\mathsf {CH_{3}COO^{-}{\xrightarrow[{}]{-e^{-}}}CH_{3}COO^{\cdot }{\xrightarrow[{}]{-CO_{2}}}{CH_{3}}^{\cdot }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2b3e525f52aaed6657de44d0bb8187b72d29252a)
![{\displaystyle {\mathsf {Ph_{2}Hg{\xrightarrow[{}]{hv}}Ph^{\cdot }+PhHg^{\cdot }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/66a0e0739f5323636757bf8941fd6dcb6c05b481)
![{\displaystyle {\mathsf {(CH_{3})_{3}COOC(CH_{3})_{3}{\xrightarrow[{}]{t}}2(CH_{3})_{3}CO^{\cdot }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/14e59319db3dee6e1332c591805df71eb8d42b2a)

















Комментариев нет:
Отправить комментарий