ცოდნა სინათლეა - Knowledge is light - Знание свет -
| ზოგადი თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| მარტივი ნივთიერების ვიზუალური აღწერა | მოვერცხლისფრო-თეთრი ძალიან მყარი, ძნელდნობადი ლითონი | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სტანდ. ატომური წონა Ar°(Ir) | 192.217±0.002 192.22±0.01 (დამრგვალებული) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ირიდიუმი პერიოდულ სისტემაში | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომური ნომერი (Z) | 77 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ჯგუფი | 9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| პერიოდი | 6 პერიოდი | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბლოკი | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონული კონფიგურაცია | [Xe] 4f14 5d7 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტრონი გარსზე | 2, 8, 18, 32, 15, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ელემენტის ატომის სქემა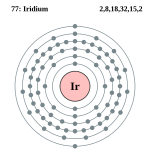 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ფიზიკური თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| აგრეგეგატული მდგომ. ნსპ-ში | მყარი სხეული | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დნობის ტემპერატურა | 2446 °C (2719 K, 4435 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დუღილის ტემპერატურა | 4130 °C (4403 K, 7466 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სიმკვრივე (ო.ტ.) | 22.56 გ/სმ3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სიმკვრივე (ლ.წ.) | 19 გ/სმ3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დნობის კუთ. სითბო | 41.12 კჯ/მოლი | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| აორთქ. კუთ. სითბო | 564 კჯ/მოლი | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მოლური თბოტევადობა | 25.10 ჯ/(მოლი·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ნაჯერი ორთქლის წნევა
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომის თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ჟანგვის ხარისხი | −3, −1, 0, +1, +2, +3, +4, +5, +6, +7, +8, +9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროდული პოტენციალი | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ელექტროუარყოფითობა | პოლინგის სკალა: 2.20 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| იონიზაციის ენერგია |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ატომის რადიუსი | ემპირიული: 136 პმ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| კოვალენტური რადიუსი (rcov) | 141±6 პმ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ირიდიუმის სპექტრალური ზოლები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| სხვა თვისებები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბუნებაში გვხვდება | პირველადი ნუკლიდების სახით | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მესრის სტრუქტურა | კუბური წახნაგცენტრირებული | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბგერის სიჩქარე | 4825 მ/წმ (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| თერმული გაფართოება | 6.4 µმ/(მ·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| თბოგამტარობა | 147 ვტ/(მ·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| კუთრი წინაღობა | 47.1 ნომ·მ (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მაგნეტიზმი | პარამაგნეტიკი | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მაგნიტური ამთვისებლობა | +25.6×10−6 სმ3/მოლ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| იუნგას მოდული | 528 გპა | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| წანაცვლების მოდული | 210 გპა | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| დრეკადობის მოდული | 320 გპა | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| პუასონის კოეფიციენტი | 0.26 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| მოოსის მეთოდი | 6.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ვიკერსის მეთოდი | 1760–2200 მპა | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ბრინელის მეთოდი | 1670 მპა | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS ნომერი | 7439-88-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ისტორია | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| აღმომჩენი და პირველი მიმღებია | სმიტსონ ტენანტი (1803) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ირიდიუმის მთავარი იზოტოპები | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
ირიდიუმი (ლათ. Iridium < ბერძ. iridos — „ცისარტყელა“; ქიმიური სიმბოლო — ) — ელემენტთა პერიოდული სისტემის მეექვსე პერიოდის, მეცხრე ჯგუფის (მოძველებული კლასიფიკაციით — მერვე ჯგუფის თანაური ქვეჯგუფის, VIIIბ) ქიმიური ელემენტი. მისი ატომური ნომერია — 77, ატომური მასა — 192.22, tდნ — 2446 °C, tდუღ — 4130 °C, სიმკვრივე — 22.56 გ/სმ3. მოვერცხლისფრო-თეთრი ძალიან მყარი, ძნელდნობადი და ქიმიურად მედეგი ლითონი. შედის გარდამავალ ლითონთა ჯგუფში. პლატინის ჯგუფიდან, რომელსაც აქვს მაღალი სიმკვრივე და ამ პარამეტრით შეედრება მხოლოდ ოსმიუმს (Os და Ir სიმკვრივე პრაქტიკულად ტოლია გამოთვლითი ცდომილების გათვალისწინებით). აქვს მაღალი კოროზია მედეგობა 2000 °C-ზეც კი.
ისტორია
ირიდიუმი აღმოჩენილ იქნა 1803 წელს ინგლისელი ქიმიკოსის სმიტსონ ტენანტის მიერ ოსმიუმთან ერთად, რომლებიც როგორც მინარევები იყვნენ ბუნებრივ პლატინაში, რომელიც ჩამოტანილია იყო სამხრეთ ამერიკიდან. სახელწოდება (ძვ. ბერძნ. ἶρις — ცისარტყელა) მიიღო მისი მარილების სხვადასხვა შეფერილობის გამო.
ბუნებაში
ირიდიუმის შემცველობა დედამიწის ქერქში ძალიან უმნიშვნელოა (მასის 10−7 %). ის გვხვდება უფრო იშვიათად ვიდრე ოქრო და პლატინა. გვხვდება როდიუმთან, რენიუმთან და რუთენიუმთან ერთად. მიეკუთვნება ყველაზე ნაკლებად გავრცელებულ ელემენტებს. ირიდიუმი შედარებით ხშირად გვხვდება მეტეორიტებში. არა არის გამორიცხული, რომ პლანეტაზე ლითონის რეალური შემცველობა გაცილებით მეტი იყოს: მის მაღალ სიმკვრივეს და რკინასთან ძლიერ მსგავსებას (სიდეროფილურობა) შეიძლება გამოეწვია ირიდიუმის არევა დედამიწის სიღრმეში, პლანეტის ბირთვში,გადანადნობიდან მისი ფორმირების პროცესში.
ირიდიუმი შედის ისეთი მინერალების შემადგენლობაში როგორიცაა, ნევიანსკიტი, სისერტსკიტი და აუროსმირიდი.
საბადოები
ოსმიუმიანი ირიდიუმის ძირეული საბადოები მდებარეობენ ძირითადად პერიტიტოვური სერპენტინიტების მდებარეობის რაიონებში (სამხრეთ აფრიკის რესპუბლიკა, კანადა, აშშ, ახალი გვინეა).
მიღება
ირიდიუმის მიღების ძირითად წყაროს წარმოადგენს — სპილენძ-ნიკელის წარმოების ანოდური დანალექი წიდა. პლატინის ჯგუფის ლითონების კონცენტრატებიდან გამოყოფენ Au, Pd, Pt და სხვას, ნარჩენები, რომელიც შეიცავს Ru, Os და ირიდიუმს, შეადნობენ KNO3 და КОН-თან, შენადნობს გამოატუტებენ წყლით, ხსნარს ჟანგავენ O2, აცილებენ OsO4 და RuO4, ხოლო ნალექს, რომელიც შეიცავს ირიდიუმს, შეადნობენ Na2O2 და NaOH, შენადნობს ამუშავებენ სამეფო წყალით და NH4Cl ხსნარითსადაც ირიდიუმი ილექება როგორც კომპლექსური შენაერთი (NH4)2[IrCl6], რომელსაც შემდეგ ახურებენ (ავარვარებენ), ლითონ - ირიდიუმის მიღებამდე. პერსპექტიულია ირიდიუმის გამოყოფა ექსტრაქციის მეთოდით. ირიდიუმის გამოყოფისათვის არაკეთილშობილი ლითონებისაგან პერსპექტიულია იონური ცვლის გამოყენება. ოსმიუმიანი ირიდიუმის ჯგუფის მინერალებიდან ირიდიუმის გამოყოფისათვის მინერალებს შეადნობენ ბარიუმის ოქსიდთან, ამუშავებენ ქლორწყალბადით და სამეფო წყალით, აცილებენ OsO4 და ლექავენ ირიდიუმს (NH4)2[IrCl6]-ის სახით.
ფიზიკური თვისებები
მძიმე მოვერცხლისფრო-თეთრი ლითონი, საკუთარი სიმაგრის გამო ძნელად ხდება მისი მექანიკური დამუშავება. კრისტალური სტრუქტურა აქვს — კუბურ წახნაგცენტრირებული, პერიოდით а0=0,38387 ნმ; ელექტრული წინაღობა — 5,3×10−8ომ·მ (0 °C-ზე); სითბური გაფართოების კოეფიციენტია — 6,5×10−6 გრად; ნორმალური დრეკადობის მოდულია — 52,029×106 კგ/მმ²; სიმკვრივე — 22,65 გრ/სმ³.
სტაბილურს წარმოადგენენ იზოტოპები 191Ir და 193Ir. ნახევარდაშლის პერიოდია 192Ir — 74 დღე.
ქიმიური თვისებები
ირიდიუმი მდგრადია ჰაერში ჩვეულებრივი ტემპერატურის პირობებში და გახურებისას, ფხვნილის გავარვარბისას ჟანგბადის ჭავლში 600—1000 °C-ზე ირიდიუმი ქმნის უმნიშვნელო რაოდენობით IrO2. 1200 °C-ზე ზევით ნაწილობრივ ორთქლდება IrO3 სახით. კომპაქტური ირიდიუმი 100 °C-მდე არ რეაგირებს ყველა ცნობილ მჟავასთან და მათ ნარევებთან. ახლადდალექილი შავი ირიდიუმი ნაწილობრივ იხსნება სამეფო წყალში Ir(III)-სა და Ir(IV) წარმოქმნით. ირიდიუმის ფხვნილი შეიძლება გაიხსნას ქლორირებით ტუტე ლითონების ქლორიდების თანდასწრებით 600-900 °C-ზე ან Na2O2 ან BaO2-თან შედნობით შემდეგ მჟავეებში გახსნით. ირიდიუმი ურთიერთქმედებს F2 400—450 °C-ზე, ხოლო Cl2-თან და S-თან რეაგირებს წითელი გავარვარების ტემპერატურაზე.
ორ ვალენტიანი ირიდიუმის ნაერთები
- IrCl2 — ბრჭყვიალა მუქი-მწვანე ფერის კრისტალები. ცუდად იხსნებიან მჟავეებში და ტუტეებში. გახურებისას 773 °C-მდე იშლება IrCl და ქლორად, ხოლო 798 °C-ის ზევით — იშლება შემადგენელ ელემენტებად. მიიღებენ ლითონური ირიდიუმის გახურებით ან IrCl3 ქლორის დენში 763 °C-ზე.
- IrS — ბრჭყვიალა მუქი-ლურჯი მაგარი ნივთიერება. ნაკლებად იხსნება წყალში და მჟავეებში. იხსნება კალიუმის სულფიდში. მიიღებენ ლითონური ირიდიუმის გოგირდის ორთქლში გახურებით.
სამ ვალენტიანი ირიდიუმის ნაერთები
- Ir2O3 — მაგარი მუქი-ლურჯი ნივთიერება. ნაკლებად ხსნადია წყალში და ეთანოლში. იხსნება გოგირდმჟავაში. მიიღებენ ირიდიუმის სულფიდის (III) სუსტი გავარვარებით.
- IrCl3 — ზეთის ხილის-მომწვანო ფერის აქროლადი ნაერთი. სიმკვრივეა — 5,30 გრ/სმ³. ნაკლებადხსნადია წყალში, ტუტეებში და მჟავეებში. 765 °C-ზე იშლება IrCl2-ად და ქლორად, გახურებისას 773 °C-მდე იშლება IrCl და ქლორად, ხოლო 798 °C-ზე ზევით — იშლება შემადგენელ ელემენტებად. მიიღებენ ქლორის მოქმედებით 600 °C-მდე გახურებულ ირიდიუმზე.
- IrBr3 — ზეთის ხილის-მომწვანო ფერის კრისტალები. იხსნება წყალში, ნაკლებად იხსნება სპირტში. დეჰიდრატირებს 105—120 °C-მდე გახურებისას. ძლიერი გახურებისას იშლება ელემენტებად. მიიღებენ IrO2-სა და ბრომწყალბადმჟავის ურთიერთქმედებით.
- Ir2S3 — მყარი ყავისფერი ნივთიერებაა. იშლება ელემენტებად 1050 °C-ზე ზევით გახურებისას. ნაკლებად იხსნება წყალში. იხსნება აზოტმჟავაში და კალიუმის სულფიდის ხსნარში. მიიღებენ ირიდიუმის(III) ქლორიდზე გოგირდწყალბადის ზემოქმედებით ან ფხვნილისმაგვარი ლითონური ირიდიუმის გახურებით გოგირდთან ერთად არაუმეტეს 1050 °C-ისა ვაკუუმში.
ოთხ ვალენტიანი ირიდიუმის ნაერთები
- IrO2 — შავი ტეტრაგონალური კრისტალები. სიმკვრივეა — 3,15 გრ/სმ³. ნაკლებადხსნადია წყალში, ეთანოლში და მჟავეებში. ღდგება ლითონამდე წყალბადით. გახურებისას თერმულად დისოციირებს ელემენტებამდე. მიიღებენ ფხვნილისმაგვარი ირიდიუმის გახურებით ჰაერზე ან ჟანგბადში 700 °C-ზე, IrO2*nН2О-ის გახურებით.
- IrF4 — ყვითელი ზეთოვანი სითხე, რომელიც იშლება ჰაერზე და ჰიდროლიზდება წყლით. tпл 106 °C. მიიღებენ IrF6-ის გახურებით ირიდიუმის ფხვნილთან ერთად 150 °C-ზე.
- IrCl4- ჰიგროსკოპული ყავისფერი მყარი ნივთიერება. იხსნება ცივ წყალში და იშლება თბილ წყალში. მიიღებენ ლითონური ირიდიუმის გახურებით (600—700 °C) ქლორთან ერთად მომატებული წნევის პირობებში.
- IrBr4 — ჰაერზე დნობადი ლურჯი ნივთიერება. იხსნება ეთანოლში; წყალში (დაშლით), გახურებისას დისოცირდება ელემენტებად. მიიღებენ IrO2-ის ურთიერთქმედებით ბრომწყალბადმჟავასთან დაბალი ტემპერატურის პირობებში.
- IrS2 — მყარი ყავისფერი ნივთიერება. ნაკლებადხსნადია წყალში. მიიღებენ ირიდიუმის (IV) მარილებში გოგირდწყალბადის გატარებით ან ლითონური ირიდიუმის გახურებით გოგირდთან ერთად ჰაერის გარეშე გარემოში ვაკუუმში.
ექვს ვალენტიანი ირიდიუმის ნაერთები
- IrF6 — ყვითელი ტეტრაგონალური კრისტალები. tდნ 44 °C, tდუღ 53 °C, სიმკვრივე — 6,0 გრ/სმ³. ლითონური ირიდიუმის ზემოქმედებით გარდაიქმნება IrF4-ად, ღდგება წყალბადით ლითონურ ირიდიუმის წარმოქმნამდე. მიიღებენ ირიდიუმის გახურებით ფტორის ატმოსფოროში ფლუორიტის მილაკში. ძალიან ძლიერი მჟანგავი, რომელსაც შეუძლია წყლის დაჟანგვაც კი:
2IrF6 + 10H2O = 2Ir(OH)4 + 12HF + O2, ან NO:
NO + IrF6 = NO+[IrF6]−
- IrS3 — რუხი, წყალში ნაკლებადხსნადი ფხვნილი. მიიღებენ ლითონური ირიდიუმის ფხვნილის გახურებით გოგირდთან ერთად ვაკუუმში. ანუ არ წარმოადგენს ექვს ვალენტიანი ირიდიუმის შენაერთს, რადგანაც აქვს S-S ბმა.
- Ir(OH)4 (IrO2*2H2O) წარმოიქმნება ქლოროირიდატების (IV) ხსნარების ნეიტრალიზაციის დროს მჟანგავების თანდასწრებით. ნალექი Ir2O3*nН2О ილექება ტუტეებით ქლოროირიდატების (III) ნეიტრალიზაციის დროს და ადვილად იჟანგება ჰაერზე IrO2-მდე. პრაქტიკულად არ იხსნება წყალში.
გამოყენება
განსაკუთრებულ ინტერესს იწვევს მისი ბირთვული იზომერი ირიდიუმ-192m2 (ნახევარდაშლის პერიოდი 241 წელი), როგორც ელექტროენერგიის წყარო.
მისი შენადნობი W და Th — არის თერმოელექტრული გენერატორების მასალა, Hf-თან — საწვავის ავზების მასალა კოსმოსურ აპარატებში, Rh-თან, Re-თან, W-თან — არის თერმოწყვილების მასალა, რომლებსაც იყენებენ 2000 °C-ზე ზევით, ხოლო La და Се-თან — თერმოემისიური კათოდების მასალა.
ირიდიუმი გამოიყენება ასევე საწერ კალმებში. ირიდიუმის მცირე ბურთულა შეიძლება ვნახოთ საწერ კალმების წვერში, განსაკუთრებულად კარგად ჩანს ოქროს კალმებში, სადაც ის ფერით განსხვავდება კალამისაგან.
ირიდიუმი პალეონტოლოგიაში და გეოლოგიაში წარმოადგენს ფენის ინდიკატორს, რომელიც ფორმირდა უცებვე მეტეორიტის ჩამოვარდნისთანავე.
ირიდიუმი, სპილენძთან და პლატინასთან ერთად გამოიყენება შიგა წვის ძრავის აალების სანთლებში როგორც ელექტროდების დასამზადებელი მასალა, ასეთ სანთლებს განსაკუთრებულად უხანგრძლივდება ვადა (100—160 ათ. კმ ავტომობილის გარბენი) და ამცირებს მოთხოვნებს აალების ძაბვასთან. თავდაპირველად გამოიყენებოდა ავიაციაში და სარბოლო ავტომანქანებში, შემდგომ, თვითღირებულების შემცირებასთან ერთად, დაიწყეს გამოყენება მასიურ ავტომანქანებშიც. ახლა ასეთი სანთლები ხელმისაწვდომია თითქმის ყველა ძრავისათვის, თუმცა არის ყველაზე ძვირი.
ბიოლოგიური როლი
ირიდიუმი არ თამაშობს არავითარ ბიოლოგიურ როლს. ლითონური ირიდიუმი, არატოქსიკურია, მაგრამ მისი ზოგიერთი შენაერთი, მაგალითად, მისი ჰექსაფტორიდი (IrF6), ძალიან მომწამვლელია.
ღირებულება
მსოფლიო ბაზარზე ირიდიუმის ფასი დღეს 2012 წლისათვის შეადგენს მიახლოებით 200 დოლარს ერთ გრამზე.
საინტერესო ფაქტები
ირიდიუმი — არის ლითონი, რომელიც არ ურთიერთქმედებს მჟავეებთან და ნარევებთან (მაგალითად, სამეფო წყალი) როგორც ნორმალურ ისე მაღალი ტემპერატურების პირობებში.
იხ. ვიდეო - Иридий - Самый РЕДКИЙ металл на Земле!










