აზოტმჟავა
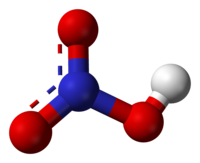
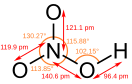
HNO2, erTfuZiani, sakmaod susti mJava. Mdgradia mxolod ganzavebul civ wyalxsnarSi. gacxelebiT da Zlieri mJavebis an damJangvelebis moqmedebiT iSleba: 3HNO2=HNO3+2HO+H2O. aq marilebi, nitritebi momwamvlelia. natriumnitrits NaNO2 iyeneben azotsaRebavebis warmoebaSi, agreTve medicinaSi stenokardiisa da tvinis sisxlZarRvTa spazmis dros.
ტრადიციული - სამეფო წყალი, აზოტის, სახელწოდება - სპირტი Eau forte, წყალბადის ნიტრატი Eau forte
დნობის ტემპერატურა - - 42 °C, დუღილის ტემპერატურა - 83 °C, არაალებადი °C, ორთქლის წნევა - 48 mmHg (20 °C), უსაფრთხოება NFPA 704
 LD50 - 138
LD50 - 138
0
3
0
OX
სუფთა სახით ნივთიერება უფეროა, მაგრამ ძველი ნიმუშები, როგორც წესი, ყვითელ შეფერილობას იღებენ, რაც ძირითადად მისი აზოტის ოქსიდებად და წყლად დაშლის გამო ხდება. კომერციულად ხელმისაწვდომი აზოტმჟავა მის 68% წყალხსნარს წარმოადგებს. როცა ხსნარი შეიცავს 86%ზე მეტ HNO3-ს, მას მბოლავი აზოტმჟავა ჰქვია. იმის მიხედვით, თუ რამდენი აზოტის დიოქსიდია მასში გახსნილი, მბოლავ აზოტმჟავას ეძახიან თეთრად მბოლავ აზოტმჟავას (WFNA) ან წითლად მბოლავ აზოტმჟავას (RFNA) (კონცენტრაცია 95%).

აზოტმჟავის ძირითადი გამოყენების სფეროა ნიტრირება — ნივთიერებისთვის (შეეხება ძირითადად ორგანული ნივთიერებებს) ნიტრო ჯგუფის დასამატებლად. ზოგიერთი მიღებული ნიტრო ნაერთები დარტყმა და თერმულად არასტაბილურია (ფეთქებადია), რამდენიმე მათგანი კი საკმაოდ მდგრადია სამხედრო და სამოქალაქო ამფეთქი ნივთიერებებისა და საღებავების საწარმოებლად. აზოტმჟავა ასევე გამოიყენება როგორც ძლიერი მჟანგავი.
იხ. ვიდეო
აზოტმჟავა თავის მთავარ ინდუსტრიულ გამოყენებას ჰპოვებს სასუქების წარმოებაში. აზოტმჟავის ამიაკით განეტრალებისას წარმოიქმნება ამონიუმის ნიტრატი. ამ რეაქციისათვის იხარჯება 75-80% მსოფლიოში წელიწადში ნაწარმოები 26 მილიონი ტონა აზოტმჟავა. მისი სხვა გამოყენებების სია შეიცავს ასაფეთქებელი ნივთიერებების წარმოებას, ნეილონის პრეკურსორებს და სპეციალურ ორგანული ნაერთებს.
ორგანული ნიტრონაერთების პრეკურსორი
ორგანულ სინთეზში, ინდუსტრიულსა თუ სხვა, ნიტროგჯუფს მრავალმხრივი გამოყენება გააჩნია. ანილინის ძირითადი ნაწარმები მზადდება არომატული ნაერთების ნიტრირებით და მათი შემდგომი აღდგენით. ნიტრაცია თავის თავში შეიცავს აზოტისა და გოგირდის მჟავებს შერევას ნიტრონიუმის იონის წარმოსაქმნელად, რომელიც ელექტროფილურად რეაგირებს ისეთ არომატულ ნაერთებთან, როგორიცაა ბენზოლი. ბევრი ფეთქებადი ნივთიერება, მაგ.ტრინიტროტოლუოლი ამ გზით მიიღება.
ნეილონის პრეკურსორი, ადიპიკის მჟავა სამრეწველო მასშტაბით მიიღება აზოტმჟავით ციკლოჰექსანონისა და ციკლოჰექსანოლის დაჟანგვით.
სარაკეტო საწვავი
აზოტმჟავა სხვადასხვა ფორმით გამოიყენებოდა როგორც მჟანგავი თხევადსაწვავიან რაკეტებში. ეს ფორმები შეიცავდა წითლად მბოლავ აზოტმჟავას, თეთრად მბოლავ აზოტმჟავას და ხსნარებს გოგირდმჟავასთან.კოროზიის ინჰიბიტორად HF იხმარებოდა . IRFNA (ინჰიბირებული წითლად მბოლავი აზოტმჟავა) ერთ-ერთი იყო სამი სითხიდან BOMARC რაკეტისათვის.
გამოყენების სხვა სფეროები
ანალიტიკური რეაგენტი
ელემენტარულ ანალიზში ICP-MSდან, ICP-AESდან, GFAAდან და Flame AAდან, 0.5-5% აზოტმჟავა გამოიყნება როგორც მატრიცული ნაერთი ხსნარებში მეტალების კვალის დასადგენად. ამ კვლევებისათვის საჭიროა ზემაღალი სისუფთავის მჟავა იმიტომ, რომ მასში მეტალის ნაერთების არსებობას კვალის სახითაც კი სერიოზული შედეგი შეიძლება ჰქონდეს.
ის ჩვეულებრივ ასევე გამოიყენება მღვრიე წყლის , ნარჩენებისა და მყარი ნიმუშების, ისევე როგორც სხვა ტიპის უნიკალური მასალების ანალიზებისათვის, რომლებზეც ელემენტარულ ანალიზს ატარებენ ICP-MS, ICP-OES, ICP-AES, GFAA და ალის ატომურ-აბსორბციული სპექტროსკოპია მეთოდებით. ჩვეულებრივ ამ ხაზით გამოყენებისათვის იხმარება 50% ხსნარი შეძენილი მჟავისა, რომელსაც ურევენ პირველი ტიპის DI წყალს.
ელექტროქიმიაში აზოტმჟავა გამოიყენება ორგანული ნახევარგამტარების ლეგირებისათვის და ნახშირბადის ნანომილებით წმენდისათვის.
ხეზე მუშაობა
დაბალი კონცენტრაციის (დაახლოებით 10%) აზოტმჟავა ხშირად გამოიყენება ფიჭვისა და ნეკერჩხლის ხელოვნურად დასაბერებლად. მიღებული მოყავისფრო-ოქროსფერი ფერი ძალიან ჰგავს ცვილით ან ზეთით დამუშავებულ ხეს (ხის დამუშავება).
ამოჭმა და გამასუფთავებელი აგენტი
აზოტმჟავის კოროზიული ეფექტები გამოიყენება ისეთი მიზნებით, როგორიცაა უჟანგავ ფოლადზე ამოწვა ან სილიკონის დაფების გაწმენდა (ელექტრონიკაში).
აზოტმჟავის, სპირტისა და წყლის ხსნარი (ნიტალი) გამოიყენება მეტალების ამოსაჭმელად მათი მიკროსტრუქტურის გამოკევლევისათვის. სტანდარტი ISO 14104 აღწერს ამ კარგად ცნობილ პროცედურას.
გასაყიდად ხელმისაწვდომი 5-30% აზოტმჟავისა და 15-40% ფოსფორმჟავის ხსნარები გამოიყენება საჭმლისა და მისი შესანახი ჭურჭლის გასაწმენდად მათგან მაგნიუმისა და კალციუმის ნაერთების მოშორების მიზნით(ნალექები ან ორთქლით დამუშავების შედეგად, ან წარმოებისას მაგარი წყლის გამოყენების გამო). ფოსფორმჟავა ეხმარება რკინის შენადნობებს განზავებული აზოტმჟავის მიმართ პასივაციაში.
აზოტმჟავა ასევე შეიძლება გამოყენებული იქნა ალკალოიდების ტესტში, მაგალითად LSD. ალკალოიდის ტიპის მიხედვით ხსნარი სხვადასხვა შეფერილობას იძენს.
უაფრთხოება

აზოტმჟავასგან მიღებული მეორე ხარისხის დამწვრობა
აზოტმჟავა კოროზიული მჟავაა და ძლიერი მჟანგავია. ყველაზე საშიშია ქიმიური დამწვრობა, რომელსაც იწვევს პროტეინების, ამიდების და ცხიმების (ესტერების) მჟავური ჰიდროლიზი, რომელიც თანდათან იწვევს ქსოვილის დაშლას (მაგ. კანის და ხორცის). კონცენტრირებული აზოტმჟავა ღებავს ადამიანის კანს ყვითელ ფრად, რაც გამოწვეულია მის კერატინთან ურთიერთქმედებით. ყვითელი ფერი ნეიტრალიზაციისას ფორთოხლისფრდება. სისტემატური ეფექტები არ გააჩნია და ნივთიერება არაა მიჩნეული არც კარცინოგენად და არც მუტაგენად.
ისევე როგორც სხვა კოროზიული ნივთიერებების შემთხვევაში, პირველად დახმარებას კანთან კონტაქტის დროს წარმოადგენს მისი ჩამობანა დიდი რაოდენობის წყლით. რეცხვა გრძელდება 10-15 წუთის განმავლობაში დამწვრობის გარშემო მის გასაგრილებლად და ასევე მეორადი დამწვრობის თავიდან ასაცილებლად. ასევე საჭიროა სასწრაფოდ მოვიშოროთ დაბინძურებული ტანსაცმელი და მის ქვეშ მდებარე კანის გულითადად გარეცხვა.
იქიდან გამომდინარე, რომ აზოტმჟავა ძლიერ მჟანგავს წარმოადგენს, მისი რეაქცია ისეთ ნივთიერებებთან, როგორებიცაა ციანიდები, კარბიდები და მეტალების ფხვნილები შეიძლება აფეთქებით დასრულდეს და რეაქციები ზოგიერთ ორგანულ ნივთიერებასთან (მაგ. ტურპენტინთან) ძალიან ძლიერი და ხანდახან ჰიპერგოლურია (ანუ თვითაალებადი). ამიტომ ის ყოველგვარი შესაძლო ორგანიკისა და ფუძეებისაგან შორს ინახება.
ორგანიზმზე მოქედება

იხ.ვიდეო
რეკლამა
იხ. ბმულზე ➤➤➤➤




Комментариев нет:
Отправить комментарий