ცოდნა სინათლეა - Knowledge is light - Знание свет -
ვანადიუმი
| მარტივი ნივთიერების ვიზუალური აღწერა | მოვერცხლისფრო-თეთრი | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| სტანდ. ატომური წონა Ar°(V) | 50.9415±0.0001 50.942±0.001 (დამრგვალებული) | ||||||||||||||||||||||||||||
| ვანადიუმი პერიოდულ სისტემაში | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| ატომური ნომერი (Z) | 23 | ||||||||||||||||||||||||||||
| ჯგუფი | 5 | ||||||||||||||||||||||||||||
| პერიოდი | 4 პერიოდი | ||||||||||||||||||||||||||||
| ბლოკი | |||||||||||||||||||||||||||||
| ელექტრონული კონფიგურაცია | [Ar] 3d3 4s2 | ||||||||||||||||||||||||||||
| ელექტრონი გარსზე | 2, 8, 11, 2 | ||||||||||||||||||||||||||||
ელემენტის ატომის სქემა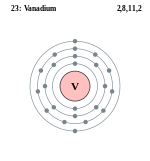 | |||||||||||||||||||||||||||||
| ფიზიკური თვისებები | |||||||||||||||||||||||||||||
| აგრეგეგატული მდგომ. ნსპ-ში | მყარი სხეული | ||||||||||||||||||||||||||||
| დნობის ტემპერატურა | 1910 °C (2183 K, 3470 °F) | ||||||||||||||||||||||||||||
| დუღილის ტემპერატურა | 3407 °C (3680 K, 6165 °F) | ||||||||||||||||||||||||||||
| სიმკვრივე (ო.ტ.) | 6.11 გ/სმ3 | ||||||||||||||||||||||||||||
| სიმკვრივე (ლ.წ.) | 5.5 გ/სმ3 | ||||||||||||||||||||||||||||
| დნობის კუთ. სითბო | 21.5 კჯ/მოლი | ||||||||||||||||||||||||||||
| აორთქ. კუთ. სითბო | 444 კჯ/მოლი | ||||||||||||||||||||||||||||
| მოლური თბოტევადობა | 24.89 ჯ/(მოლი·K) | ||||||||||||||||||||||||||||
ნაჯერი ორთქლის წნევა
| |||||||||||||||||||||||||||||
| ატომის თვისებები | |||||||||||||||||||||||||||||
| ჟანგვის ხარისხი | −3, −1, 0, +1, +2, +3, +4, +5 | ||||||||||||||||||||||||||||
| ელექტროდული პოტენციალი | |||||||||||||||||||||||||||||
| ელექტროუარყოფითობა | პოლინგის სკალა: 1.63 | ||||||||||||||||||||||||||||
| იონიზაციის ენერგია |
| ||||||||||||||||||||||||||||
| ატომის რადიუსი | ემპირიული: 134 პმ | ||||||||||||||||||||||||||||
| კოვალენტური რადიუსი (rcov) | 153±8 პმ | ||||||||||||||||||||||||||||
ვანადიუმის სპექტრალური ზოლები | |||||||||||||||||||||||||||||
| სხვა თვისებები | |||||||||||||||||||||||||||||
| ბუნებაში გვხვდება | პირველადი ნუკლიდების სახით | ||||||||||||||||||||||||||||
| მესრის სტრუქტურა | კუბური მოცულობაცენტრირებული | ||||||||||||||||||||||||||||
| ბგერის სიჩქარე | 4560 მ/წმ (20 °C) | ||||||||||||||||||||||||||||
| თერმული გაფართოება | 8.4 µმ/(მ·K) (25 °C) | ||||||||||||||||||||||||||||
| თბოგამტარობა | 30.7 ვტ/(მ·K) | ||||||||||||||||||||||||||||
| კუთრი წინაღობა | 197 ნომ·მ (20 °C) | ||||||||||||||||||||||||||||
| მაგნეტიზმი | პარამაგნეტიკი | ||||||||||||||||||||||||||||
| მაგნიტური ამთვისებლობა | +255.0×10−6 სმ3/მოლ | ||||||||||||||||||||||||||||
| იუნგას მოდული | 128 გპა | ||||||||||||||||||||||||||||
| წანაცვლების მოდული | 47 გპა | ||||||||||||||||||||||||||||
| დრეკადობის მოდული | 160 გპა | ||||||||||||||||||||||||||||
| პუასონის კოეფიციენტი | 0.37 | ||||||||||||||||||||||||||||
| მოოსის მეთოდი | 6.7 | ||||||||||||||||||||||||||||
| ვიკერსის მეთოდი | 628–640 მპა | ||||||||||||||||||||||||||||
| ბრინელის მეთოდი | 600–742 მპა | ||||||||||||||||||||||||||||
| CAS ნომერი | 7440-62-2 | ||||||||||||||||||||||||||||
| ისტორია | |||||||||||||||||||||||||||||
| აღმომჩენია | Andrés Manuel del Río (1801) | ||||||||||||||||||||||||||||
| პირველი მიმღებია | Henry Enfield Roscoe (1867) | ||||||||||||||||||||||||||||
| სახელი დაარქვა | Nils Gabriel Sefström (1830) | ||||||||||||||||||||||||||||
| ვანადიუმის მთავარი იზოტოპები | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
ვანადიუმი (ლათ. Vanadium; ქიმიური სიმბოლო — ) — ელემენტთა პერიოდული სისტემის მეოთხე პერიოდის, მეხუთე ჯგუფის (მოძველებული კლასიფიკაციით — მეხუთე ჯგუფის თანაური ქვეჯგუფის, Vბ) ქიმიური ელემენტი. მისი ატომური ნომერია 23, ატომური მასა — 50.942, tდნ — 1910 °C, tდუღ — 3407 °C, სიმკვრივე — 6.11 გ/სმ3. მოვერცხლისფრო-რუხი ფერის პლასტიკური ლითონი.
ისტორია
ვანადიუმი აღმოჩენილ იქნა 1801 წ. მეხიკოელი მინერალოგიის პროფესორის ანდრეს მანუელ დელ რიოს მიერ ტყვიის მადნებში. მან აღმოაჩინა ახალი ლითონი და მისთვის სახელად «პანქრომიუმი» შეარჩია, მისი ნაერთების ფერების ფართო დიაპაზონის გამო, შემდგომ კი შეუცვალა სახელი და უწოდა «ერითრონიუმი». დელ რიოს არ გააჩნდა ავტორიტეტი ევროპის მეცნიერულ წრეებში და ევროპელმა ქიმიკოსებმა ეჭვი შეიტანეს მის რეზულტატებში. შემდგომ კი მანაც დაკარგა თავდაჯერებულობა თავის აღმოჩენაში და განაცხადა, რომ აღმოაჩინა მხოლოდ ტყვიის ქრომატი.
1830 წელს ვანადიუმი ხელახლა იქნა აღმოჩენილი შვედი ქიმიკოსის ნილს სეფსტრემის მიერ რკინის მადანში. ახალ ელემენტს სახელწოდება მისცეს ბერცელიუსმა და სეფსტრემმა.
ვანადიუმის აღმოჩენის შანსი ჰქონდა ფრიდრიხ ველერს, რომელიც იკვლევდა მექსიკურ მადანს, მაგრამ სერიოზულად მოიწამლა ფტორწყალბადით ვანადიუმის აღმოჩენამდე და ვერ შეძლო კვლევების გაგრძელება. თუმცა ველერმა დაამტკიცა რომ მადანი შეიცავდა ვანადიუმს და არა ქრომს.
სახელწოდების წარმოშობა
ეს ელემენტი წარმოქმნის ძალიან ლამაზი შეფერილობის ნაერთებს, აქედანაა ელემენტის სახელწოდებაც, რომელიც უკავშირდება სკანდინავიური სიყვარულისა და სილამაზის ქალღმერთ ფრეიას (ძვ.-სკანდ. Vanadís — ვანების ქალიშვილი; ვანადისი).
ბუნებაში არსებობა
ვანადიუმი მიეკუთვნება გაბნეულ ელემენტებს და ბუნებაში თავუსუფალი სუფთა სახით არ გვხვდება. დედამიწის ქერქში ვანადიუმის შემცველობა მასის მიხედვით სავარაუდოდ შეადგენს 1,6×10−2%, ოკეანეების წყლებში 3×10−7%. ვანადიუმის საშუალოდ ყველაზე მეტი შემცველობა შეიმჩნევა მაგმატურ ქანებში განსაკუთრებულად გაბროში და ბაზალტში (230—290 გ/ტ). დანალექ ქანებში ვანადიუმის მნიშვნელოვანი დაგროვება ხდება ბიოლიტებში (ასფალტიტებში, ნახშირებში, ბითომინოზურ ფოსფატებში), ბითუმინოზურ ფიქალებში, ბოქსიტებში, და ასევე ოოლიტურ და სილიციუმიან რკინის მადნებში. ვანადიუმის იონური რადიუსების სიახლოვეს და მაგმატურ ქანებში ფართოდ გავრცელებულ რკინას და ტიტანს მივყავართ იქამდის, რომ ვანადიუმი ჰიპიგენურ პროცესებში მთლიანად გაბნეულ მდგომარეობაშია და არ წარმოქმნის საკუთარ მინერალებს. მის მატარებლებს წარმოადგენენ ტიტანის მრავალრიცხოვანი მინერალები (ტიტანომაგნეტიტი, სფენი, რუტილი, ილმენიტი), სლუდი, პიროქსენი და ძოწი, რომელსაც გააჩნია მაღალი იზომორფული ტევადობა ვანადიუმის მხრივ. მნიშვნელოვანი მინერალებია: პატრონიტი V(S2)2, ვანადინიტი Pb5(VO4)3Cl და სხვა. ვანადიუმის მიღების ძირითად წყაროს წარმოადგენს — რკინის მადნები, რომლებიც ვანადიუმს შეიცავენ როგორც მინარევს.
საბადოების მდებარეობა
ცნობილია საბადოები პერუში, კოლორადო აშშ-ში, სამხრეთ აფრიკის რესპუბლიკაში, ფინეთში, ავსტრალიაში, სომხეთში, რუსეთში.
მიღება
მრეწველობაში ვანადიუმის მიღებისთვის, მინარევებიანი რკინის მადნიდან თავდაპირველად ამზადებენ კონცენტრატს, რომელშიც ვანადიუმის კონცენტრაცია აღწევს 8-16 %. შემდგომ ჟანგვითი დამუშავებით ვანადიუმი გადაყავთ უმაღლესი დაჟანგვის ხარისხში +5 და გამოყოფენ წყალში ადვილად ხსნად ნატრიუმის ვანადატს (Na) NaVO3. ხსნარში გოგირდმაჟავის მცირე დამატებით წარმოიქმნება ნალექი, რომელიც გაშრობის შემდეგ შეიცავს 90 %-ზე მეტ ვანადიუმს.
პირველად კონცენტრატს აღადგენენ დომენის ღუმელებში და მიიღებენ ვანადიუმის კონცენტრატს, რომელსაც შემდგომ გამოიყენებენ ვანადიუმისა და რკინის შენადნობის — ეგრეთ წოდებული ფეროვანადიუმის (შეიცავს 35-დან 80 %-მდე ვანადიუმს) გამოდნობისას. ლითონური ვანადიუმი შეიძლება დამზადდეს ვანადიუმის ქლორიდის აღდგენით წყალბადის (H) მეშვეობით, ვანადიუმის ოქსიდების თერმული აღდგენით (V2O5 ან V2O3) კალციუმით, თერმული დისოციაციით VI2 და სხვა მეთოდებით.
ფიზიკური თვისებები

ვანადიუმი — პლასტიკური მოვერცხლისფრო-რუხი ფერის ლითონია, გარეგნულად ძალიან ჰგავს ფოლადს. კრისტალური მესერი კუბური მოცულობა ცენტრირებულია, a=3,024 Å, z=2, სივრცული ჯგუფი - Im3m. დნობის ტემპერატურა 1920 °C, დუღილის ტემპერატურა 3400 °C, სიმკვრივე 6,11 გ/სმ³. ჰაერზე გახურებისას 300 °C-ზე ზევით ვანადიუმი ხდება მყიფე. ჟანგბადის, წყალბადის და აზოტის მინარევები მკვეთრად ამცირებენ ვანადიუმის პლასტიკურობას და ამაღლებენ მის სიმაგრეს და სიმყიფეს.
ქიმიური თვისებები
ქიმიურად ვანადიუმი საკმაოდ ინერტულია. ის მდგრადია ზღვის წყლის, მარილმჟავის, აზოტმჟავის, გოგირდმაჟავის და ტუტეების გაზავებული ხსნარების მიმართ.
ჟანგბადთან ვანადიუმი წარმოქმნის რამდენიმე ოქსიდს: VO, V2O3, VO2,V2O5. ნარინჯისფერი V2O5 — მჟავა ოქსიდია, მუქი-ლურჯი VO2 — ამფოტერულია, ვანადიუმის დანარჩენი ოქსიდები - ფუძე ოქსიდებია. ვანადიუმის ჰალოგენიდები ჰიდროლიზდება.
ჰალოგენებთან ვანადიუმი წარმოქმნის საკმაოდ მფრინავ ჰალოგენიდებს, შემადგენლობით VX2 (X = F, Cl, Br, I), VX3, VX4 (X = F, Cl, Br), VF5 და რამდენიმე ოქსოჰალოგენიდი (VOCl, VOCl2, VOF3 და სხვა).
ცნობილია ვანადიუმის შემდეგი ოქსიდები:
| სახელწოდება | ფორმულა | სიმკვრივე | დნობის ტემპერატურა | დუღილის ტემპერატურა | ფერი |
|---|---|---|---|---|---|
| ანადიუმის ოქსიდი(II) | VO | 5,76 გ/სმ³ | ~1830 °C | 3100 °C | შავი |
| ვანადიუმის ოქსიდი(III) | V2O3 | 4,87 გ/სმ³ | 1967 °C | 3000 °C | შავი |
| ვანადიუმის ოქსიდი(IV) | VO2 | 4,65 გ/სმ³ | 1542 °C | 2700 °C | მუქი-ცისფერი |
| ვანადიუმის ოქსიდი(V) | V2O5 | 3,357 გ/სმ³ | 670 °C | 2030 °C | მოწითალო-ყვითელი |
ვანადიუმის ნაერთები დაჟანგვის ხარისხით +2 და +3 — ძლიერი აღმდგენებია, +5 დაჟანგვის ხარისხით ავლენს დამჟანგავის თვისებებს. ცნობილია ძნელადმდნობი ვანადიუმის კარბიდი VC (tпл=2800 °C), ვანადიუმის ნიტრიდი VN, ვანადიუმის სულფიდი V2S5, ვანადიუმის სილიციდი V3Si და ვანადიუმის სხვა ნაერთები.
V2O5 ურთიერთქმედებით ფუძე ოქსიდებთან წარმოიქმნება ვანადატები — ვანადიუმის მჟავის მარილები, სავარაუდო შემადგენლობით HVO3.
გამოყენება
მთლიანად წარმოებული ვანადიუმის 80 % გამოიყენება შენადნობებში, ძირითადად უჟანგავ და ინსტრუმენტალურ ფოლადებში.
ვანადიუმის ქლორიდი გამოიყენება წყლის თერმოქიმიური დაშლისას თერმობირთვულ ენერგეტიკაში (ვანადიუმ-ქლორიდული ციკლი «ჯენერალ მოტორსი»,აშშ). მეტლურგიაში ვანადიუმი აღინიშნება ასო V (ფაუ)-თი.
ვანადიუმის პენტაოქსიდი ფართოდ გამოიყენება ლითიურ ბატარეებში და აკუმულატორებში, როგორც დადებითი ელექტროდი (ანოდი). ვერცხლის ვანადატი სათადარიგო ბატარეებში, როგორც კათოდი.
ბიოლოგიური როლი და ზემოქმედება
დადგენილია, რომ ვანადიუმს შეუძლია ცხიმოვანი მჟავების სინთეზის შენელება, დამუხრუჭება, დათრგუნოს ქლორესტერინის წარმოქმნა. ვანადიუმი აინჰიბირებს მთელ რიგ ფერმენტულ სისტემებს, ამუხრუჭებს ფერმენტ ადენოზინტრიფოსფორმჟავას (ატფ) ფოსფორილებას და სინთეზს, ამცირებს კოფერმენტი ა-ს და უბიხინონის (Q) დონეს, ასტიმულირებს მონოამინოქსიდაზების აქტივობას და ჟანგვად ფოსფორილებას. ცნობილია ასევე, რომ შიზოფრენიის დროს ვანადიუმის შემცველობა სისხლში საკმაოდ მატულობს.
ჭარბი ვანადიუმის მოხვედრა ორგანიზმში ჩვეულებრივ დაკავშირებულია ეკოლოგიურ და საწარმოო ფაქტორებთან. ვანადიუმის მწვავე ტოქსიკური დოზების ზემოქმედებისას მუშებზე იწვევს კანის და თვალის ლორწოვანი გარსის, ზედა სასუნთქი გზების ადგილობრივ ანთებით რეაქციებს და ლორწოს დაგროვებას ბრონქებში და ალვეოლებში. ასევე წარმოიქმნება ასთმისა და ეგზემის ტიპის სისტემური ალერგიული რეაქცია; იწვევს ლეიკოპენიას და ანემიას, რომლებსაც თან ახლავს ორგანიზმის ძირითადი ბიოქიმიური პარამეტრების მოშლას.
ცხოველებში ვანადიუმის შეყვანისას (დოზა 25-50 მკგ/კგ), აღინიშნება ზრდის შენელება, დიარეა და სიკვდილიანობის ზრდა.
საშუალო ადამიანის (სხეულის წონა 70 კგ) ორგანიზმში სულ არის 0,11 მგ ვანადიუმი. ვანადიუმი და მისი ნაერთები ტოქსიკურები არიან. ადამიანისათვის ტოქსიკური დოზაა 0,25 მგ, სასიკვდილო დოზაა — 2-4 მგ.
ცილებისა და ქრომის ჭარბი შემცველობა რაციონში ამცირებს ვანადიუმის ტოქსიკურ ზემოქმედებას. მოხმარების ნორმები ამ მინერალური ნივთიერებისათვის არ არის დადგენილი.
ამას გარდა ზოგ ორგანიზმს, მაგალითად, ზღვის ფსკერის მობინადრე ჰოლოთურიებს და ასციდიებს უგროვდებათ, კონცენტრირდება ვანადიუმი ცელომიურ სითხეში/სისხლში, ამასთან მისი კონცენტრაცია აღწევს 10 %! ანუ ეს ცხოველები არიან ვანადიუმის ბუნებრივი კონცენტრატორები. მისი ფუნქცია ჰოლოთურიის ორგანიზმში ჯერ კიდევ ბოლომდე არ არის ცნობილი, ზოგი მეცნიერი თვლის, რომ მასზეა დამოკიდებული ან ჟანგბადის ან მკვებავი ნივთიერების გადატანა ორგანიზმში. პრაქტიკული თვალსაზრისით შესაძლებელია ვანადიუმის მოპოვება ამ ორგანიზმებიდან, ასეთი «ზღვის პლანტაციების» ეკონომიკური მიზანშეწონილობა ამ მომენტისათვის არაა ნათელი, თუმცა ასეთი საცდელი ვარიანტები უკვე არის იაპონიაში.
იზოტოპები
ბუნებრივი ვანადიუმი შედგება ორი იზოტოპისაგან: სუსტრადიოაქტიული 50V-ისაგან (იზოტოპური გავრცობადობა 0,250 %) და სტაბილური 51V-საგან (99,750 %). ვანადიუმ-50-ის ნახევარდაშლის პერიოდია 1,5×1017 წელი, ტ. е. ყველა პრაქტიკული მიზნისათვის ის შეიძლება ჩაითვალოს სტაბილურად; ეს იზოტოპი 83 % შემთხვევაში ელექტრონული მიტაცების მეშვეობით გარდაიქმნება 50Ti, ხოლო 17 % შემთხვევაში განიცდის ბეტა-მინუს-დაშლას, რის შედეგადაც გარდაიქმნება 50Cr-ად. ცნობილია ვანადიუმის 24 ხელოვნური რადიოაქტიური იზოტოპი მასური რიცხვით 40-დან 65-მდე (ასევე 5 მეტასტაბილური მდგომარეობაში). მათ შორის ყველაზე სტაბილურია 49V (T1/2=337 დღე) და 48V (T1/2=15,974 დღე).
იხ.ვიდეო - What is Vanadium? Learn in less than 5 minutes








Комментариев нет:
Отправить комментарий